Indicador del Estado de la Biodiversidad: Integridad Ecosistémica
Integridad Ecosistémica
La Integridad Ecosistémica (IE) se refiere a el estado de conservación o condición de los ecosistemas, es una medida directa de la modificación de hábitat (Equihua-Zamora M. et al, 2014; Equihua-Zamora et al, 2015). La estimación de la IE depende de varios tipos de variables como las de calibración que dan indicios de estabilidad y permanencia del estado del ecosistema, las variables instrumentales que permiten estimar la probabilidad de los diferentes valores de IE y las variables de contexto que permiten estratificar debido a condiciones diferentes en el espacio y medio ambientales (Figura 1).
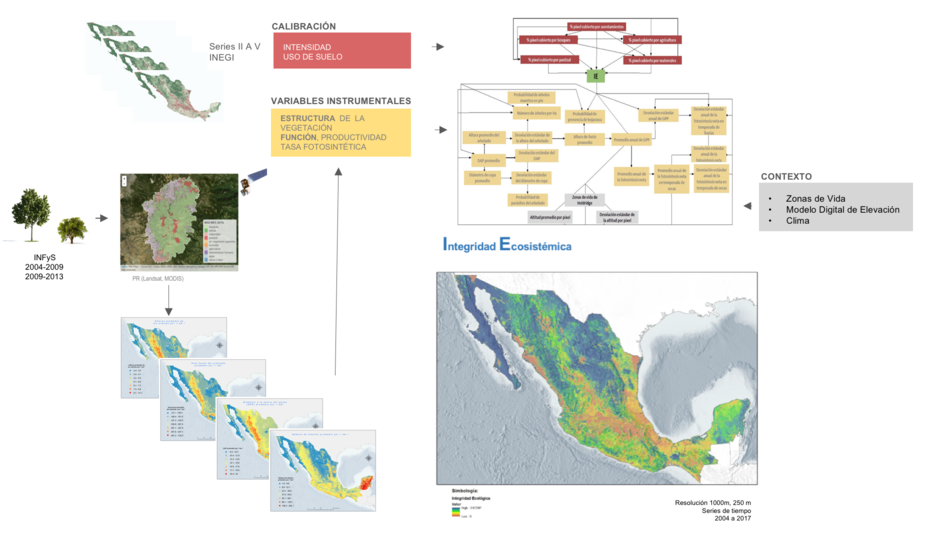
Figura 1. Integridad Ecosistémica como indicador e índices que lo conforman.
La Integridad Ecosistémica (IE) es un indicador compuesto actualmente por diversas variables de campo (estructura de la vegetación, INFyS 2004-2009, 2009-2013), de percepción remota (Landsat y MODIS), clima (temperatura y precipitación), y uso del suelo (series INEGI II a V), generado con modelos probabilísticos (redes bayesianas).De forma alternativa se incluirán las tendencias que a partir del Inventario Nacional Forestal y de Suelos (INFyS, CONAFOR), e información satelital procesada en el sistema de monitoreo, reporte y verificación de datos de actividad para México (MAD-Mex), lo que permite el cálculo de las tasas de transformación de hábitat y deforestación reciente. Asimismo serán incorporadas medidas de diversidad funcional al indicador IE, con datos de fauna que está siendo obtenidos mediante el SNMB.
Para atenuar el ruido de variación natural de los productos anuales del indicador se ajusta un modelo lineal para cada serie de tiempo-pixel y tomar como cambio cuando la pendiente es estadísticamente significativamente positiva o negativa. Los cambios anuales son sobre comportamientos lineales. La referencia para este indicador es la tendencia en el tiempo y se puede estimar además, calculando el número de unidades (pixeles) con cambio positivo (aumento) o negativo (disminución) de la Integridad Ecosistémica por año.
Tabla 1. Indices y resolución espacio temporal de la Integridad Ecosistémcia
| Indicadores | Variable Ecológica | Indices | Monitoreo | Extensión temporal | Resolución temporal | Resolución espacial |
|---|---|---|---|---|---|---|
| Integridad Ecosistémica | Múltiple | 2004-2017 | Anual | \(1km\) y \(250m\) | ||
| Cobertura de Uso de suelo | Cambios en la cobertura de uso de suelo y deforestación | Satelital | \(30m\): 2000-2010. \(5m\): 2011-2015 | 30m: 2000-2003, 2003-2005, 2005-2008, 2008-2010. 5m: 2011-2012, 2012-2013, 2013-2014, 2014-2015 | \(30m\) y \(5m\) | |
| Porcentaje de pixel con vegetación no boscosa, Porcentaje de pixel sin vegetación, Porcentaje de pixel con vegetación boscosa | Satelital | 2004-2017 | Anual | \(250m\) y \(1000m\) | ||
| Estructura de la Vegetación | Altura promedio del fuste, Desviación estándar de la altura total del arbolado, Altura promedio del arbolado, Desviación estándar del diámetro de copa del arbolado, Promedio del diámetro de copa del arbolado, Desviación estándar del diámetro a la altura del pecho, Promedio del diámetro a la altura del pecho, Probabilidad de presencia de árboles muertos en pie, Probabilidad de presencia de hojarasca en el suelo, Número de árboles por hectárea | Inventario Forestal y Satelital | 2004-2017 | Anual | \(250m\) y \(1000m\) | |
| Productividad Primaria | Promedio de la producción primaria bruta en temporada de secas, Desviación estándar de la producción primaria bruta en temporada de secas, Promedio anual de la producción primaria bruta, Desviación estándar anual de la producción primaria bruta, Promedio de la producción primaria bruta en temporada de lluvias, Desviación estándar de la producción primaria bruta en temporada de lluvias | Satelital | 2004-2017 | Anual | \(250m\) y \(1000m\) | |
| Actividad Fotosintética | Promedio de la fotosíntesis neta en temporada de secas, Desviación estándar de la fotosíntesis neta en temporada de secas, Promedio anual de la fotosíntesis neta, Desviación estándar anual de la fotosíntesis neta, Promedio de la fotosíntesis neta en temporada de lluvias, Desviación estándar de la fotosíntesis neta en temporada de lluvias | Satelital | 2004-2017 | Anual | \(250m\) y \(1000m\) | |
| Daño Vegetación | Probabilidad de presencia de plagas en árboles (muérdago, descortezadores o barrenadores) | Inventario Forestal y Satelital | 2004-2017 | Anual | \(250m\) y \(1000m\) | |
| Flora exótica-invasora | Probabilidad de especies exóticas e invasoras | Inventario Nacional Forestal y SNMB | 2015-2017, 2018-2020 | Trianual | Conglomerados |
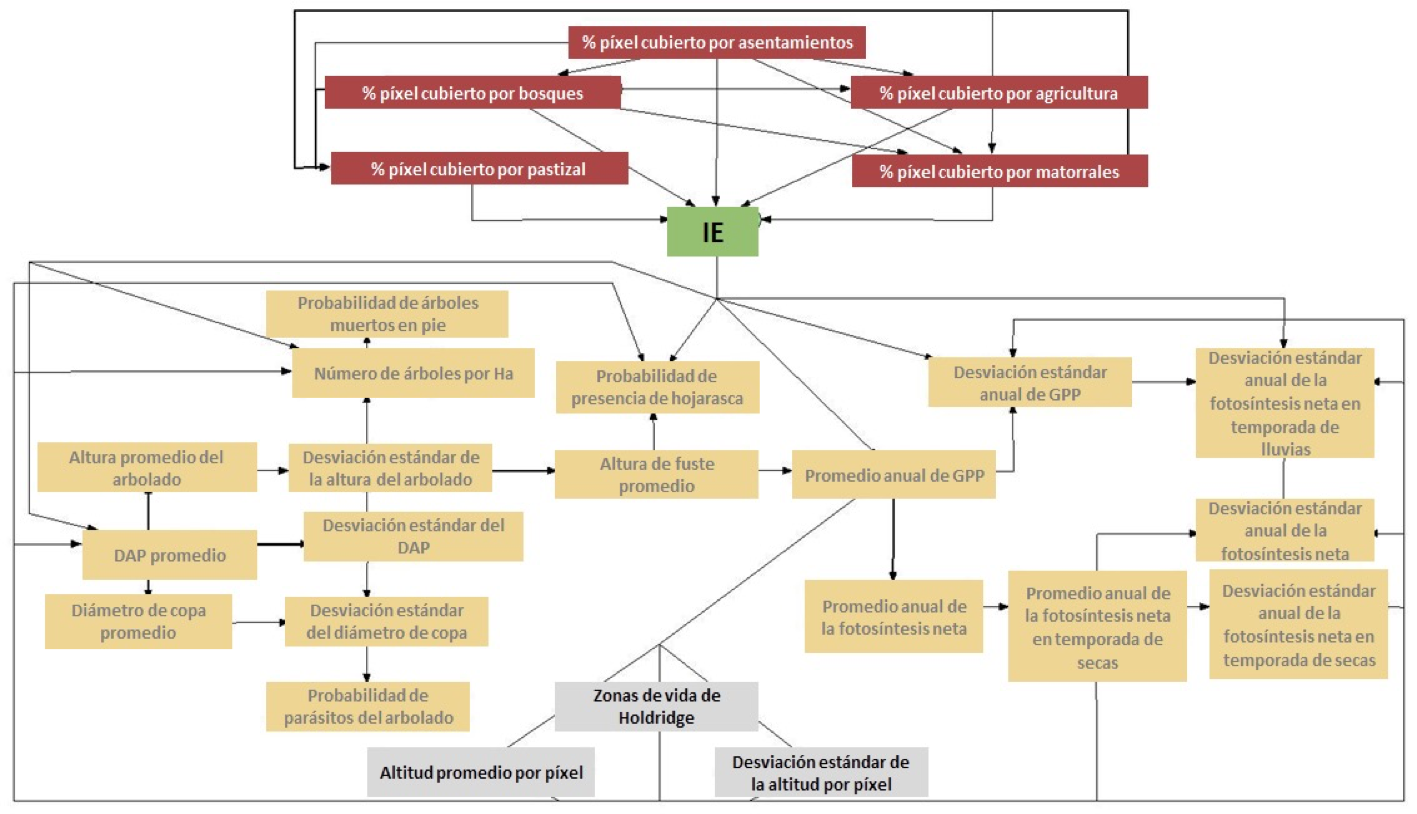
Figura 2. Red Bayesiana con la variables consideradas para el cálculo de la Integridad Ecosistémica. Las flechas indican las variables entre las que existe correlación.
Integridad Ecosistémica en Áreas Naturales Protegidas
Los indicadores del estado de la biodiversidad pretenden conocer la efectividad de las Áreas Naturales Protegidas (ANP) por lo que se compararon los valores de integridad en las zonas núcleo y de preservación dentro de las ANP y fuera de ellas. Contrasta la condición de la periferia del ANP (anillo) dónde hay una menor y mayor variabilidad de condiciones de degradación.
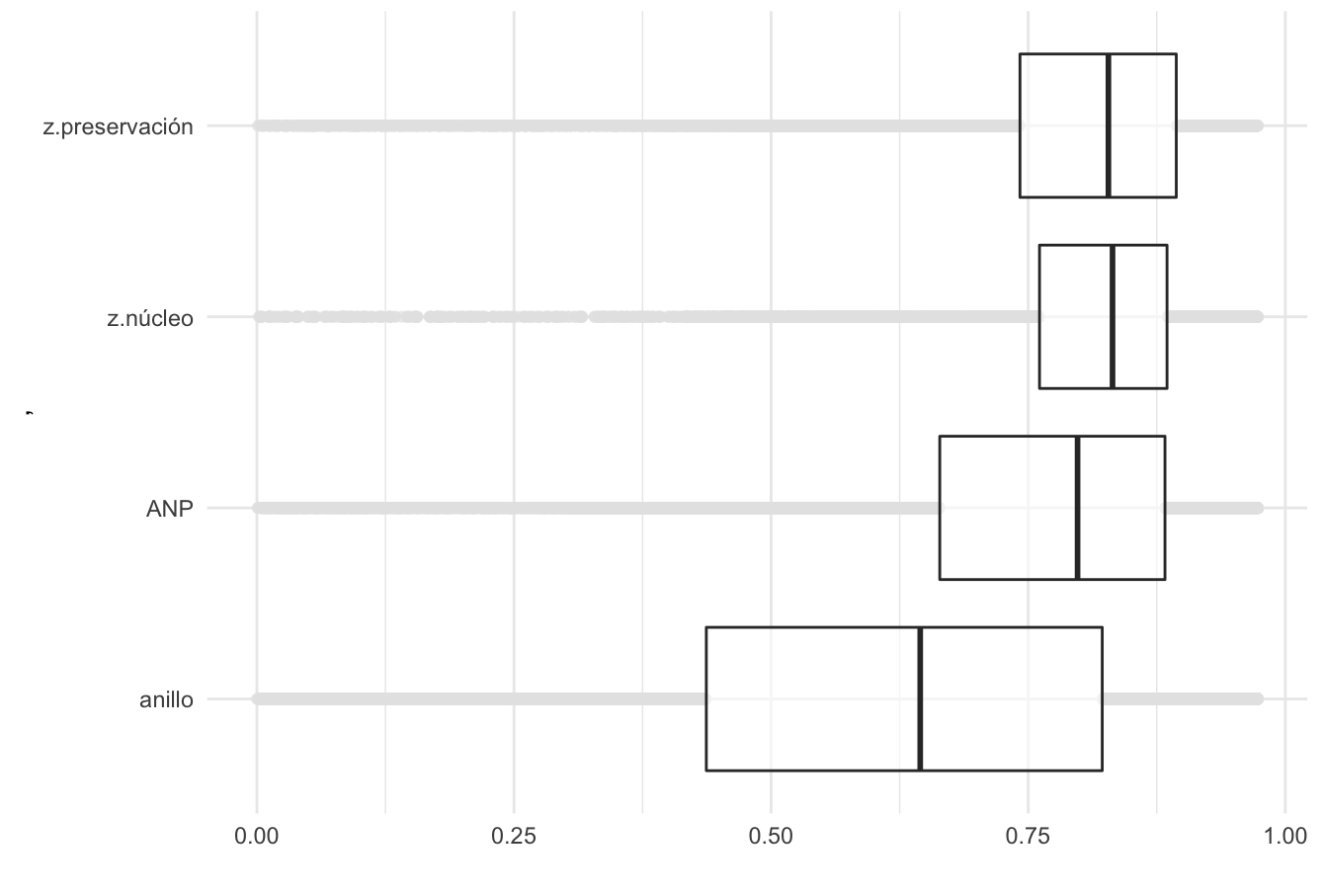
Figura 3. Integridad Ecosistémica en Áreas Naturales Protegidas terrestres de México y zonas aledañas.
Integridad Ecosistémica: Fauna
Integridad Ecosistémica: índices con monitoreo de fauna
Los índices que conformarán el modelo bayesiano de Integridad Ecosistémica integran un aspecto clave para tener indicios del estado del funcionamiento de los ecosistemas. Estos se estiman a partir de la información obtenida en el Sistema Nacional de Monitoreo de la Biodiversidad (SNMB). Los índices en el modelo de IE no sólo incorporan elementos de estructura de la vegetación si no de composición y función a escala de paisaje. Se establece el uso de medidas de representatividad y diversidad funcional de aves y murciélagos en los ecosistemas de México. Así como de medidas de tendencias sobre la calidad de hábitat de los depredadores tope (especies clave) y la representatividad de la composición de sus presas principales.
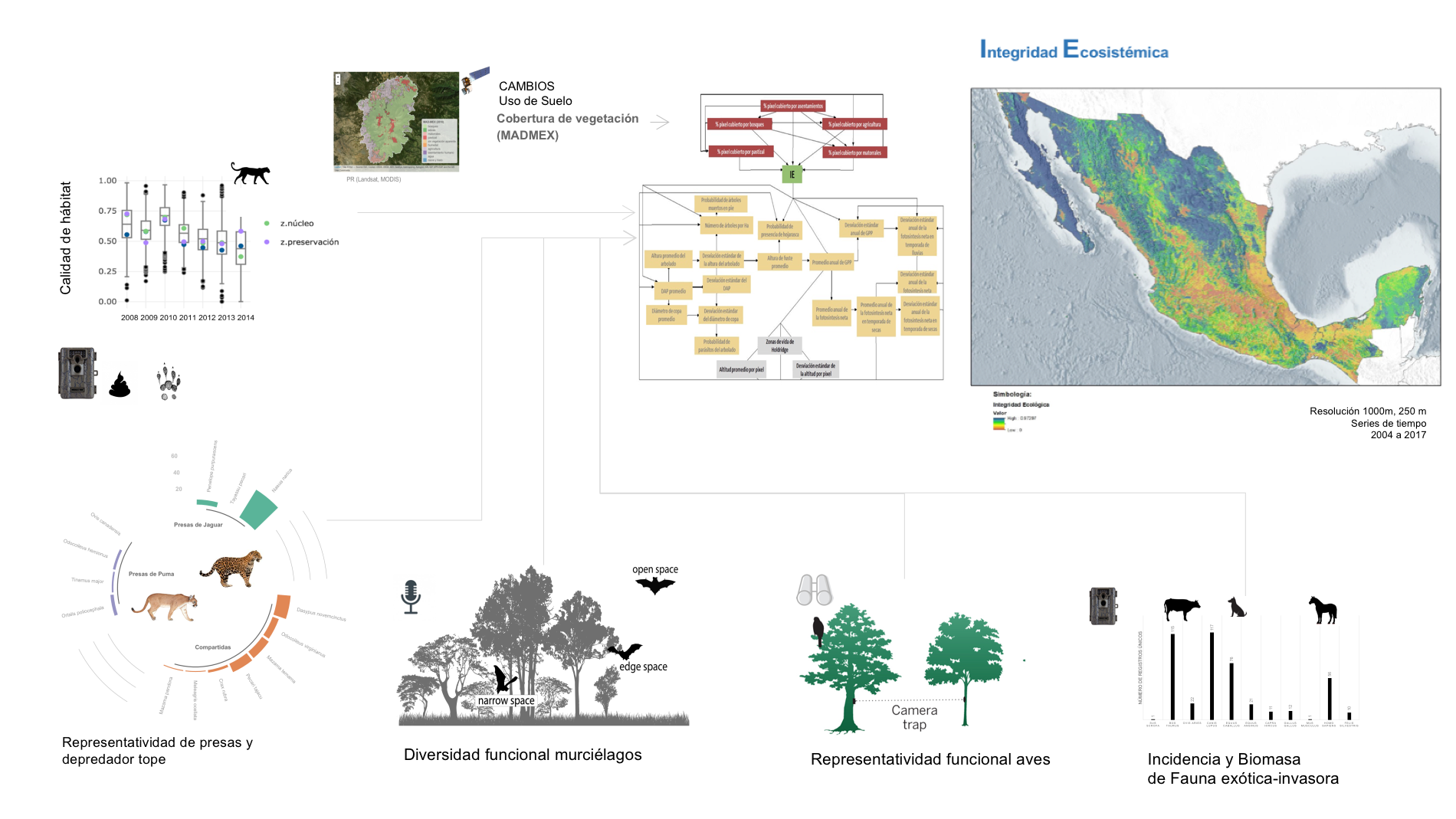
Figura 1. Integridad Ecosistémica como indicador e índices asociados a fauna que lo conformarán.
Tabla 1. Indices y resolución espacio temporal de la Integridad Ecosistémcia con índices asociados a Fauna
| Indicadores | Variable Ecológica | Indices | Monitoreo | Extensión temporal | Resolución temporal | Resolución espacial |
|---|---|---|---|---|---|---|
| Hábitat de Fauna | Calidad de hábitat de especies clave (Modelos elipsoide del nicho; Hooper et al. 2008, Angilletta 2009, Soberón and Nakamura 2009, Soberón & Peterson, 2011, Qiao et al., 2016) | Múltiple (Cámaras trampa, huellas, registros SNIB, Inventario Forestal, MAD-Mex) | 2008-2017 | Anual | \(1km\) | |
| Interacciones Ecológicas | Representatividad de presas principales de depredadores tope | Cámaras trampa, huellas y excretas | 2015-2017, 2018-2020 | Trianual | Conglomerados | |
| Murciélagos | Riqueza de especies (Índice de diversidad de Hill) | Grabaciones ultrasónicas | 2015-2017, 2018-2020 | Trianual | Conglomerados | |
| Murciélagos | Diversidad funcional (FD,Petchey & Gaston 2002) | Grabaciones ultrasónicas | 2015-2017, 2018-2020 | Trianual | Conglomerados | |
| Murciélagos | Proporción de grupos funcionales de murciélagos (Frisch-Jordán, 1995) | Grabaciones ultrasónicas | 2015-2017, 2018-2020 | Trianual | Conglomerados | |
| Aves | Diversidad de especies (Índice de diversidad de Hill) | Observación directa de Aves | 2015-2017, 2018-2020 | Trianual | Conglomerados | |
| Aves | Diversidad funcional aves (FD, Petchey & Gaston 2002) | Observación directa Aves | 2015-2017, 2018-2020 | Trianual | Conglomerados | |
| Aves | Proporción de grupos funcionales de aves (González-Salazar et al 2014) | Observación directa Aves | 2015-2017, 2018-2020 | Trianual | Conglomerados | |
| Fauna exótica-invasora | Proporción de Biomasa de mamíferos silvestres nativos y exóticos-invasores | Cámaras Trampa | 2015-2017, 2018-2020 | Trianual | Conglomerados |
Uso de Suelo
Cambio de uso de suelo y deforestación
El cambio de uso de suelo y deforestación es el factor que más ha contribuido a la modificación y pérdida de hábitat e impacta negativamente el clima, los suelos, los recursos hidrológicos, el desarrollo socio-económico y la biodiversidad (Vitousek et al, 1997, Lambin et al, 2003). Después de siglos de una expansión gradual de las áreas cultivadas en los trópicos, un aumento dramático de estas áreas a costa de la vegetación natural ha sido reportado desde la segunda mitad del siglo XX con una alta deforestación, como la que existe en el sur de México (Velázquez et al, 2002; Lambin et al, 2003; Mas et al, 2004). La conversión de la vegetación natural en espacios antrópicos causa un deterioro de los ecosistemas (Challenger, 1998; Rodrigues et al, 2000) por alterar la composición, interacción de especies y los procesos ecológicos (Hansen et al, 2004). Por esta razón, es necesario contar con indicadores de cambio de patrones y dinámica temporal de la cobertura de uso de suelo.
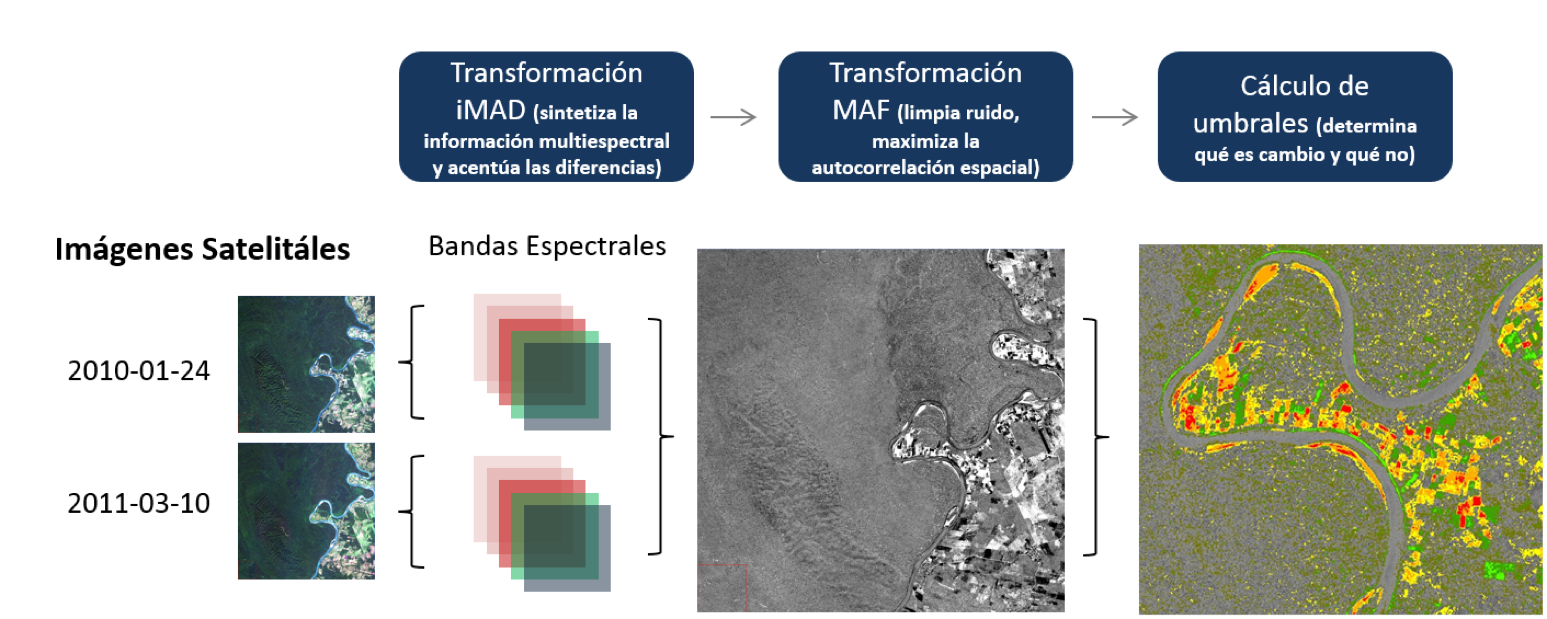
Figura 1. Procedimiento para la detección de cambios de uso de suelo a partir de imágenes satelitales.
Proporción de cobertura de tipos de vegetación y uso de Suelo
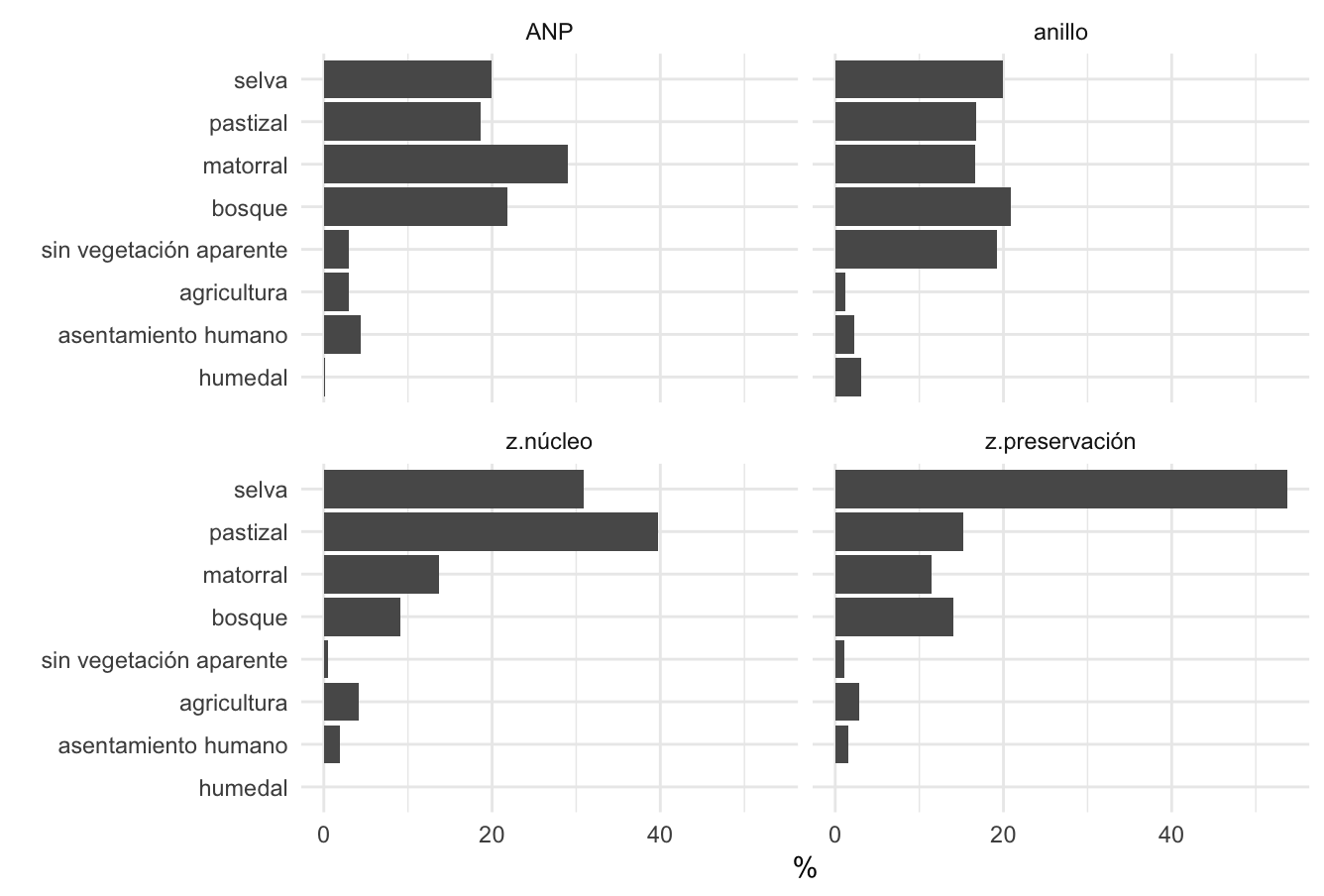
Figura 2. Porcentaje de cobertura en México en ANP, Zonas Núcleo, Preservación y Fuera de las ANP.
Perdida de Vegetación y Tasas de Transformación de Hábitat
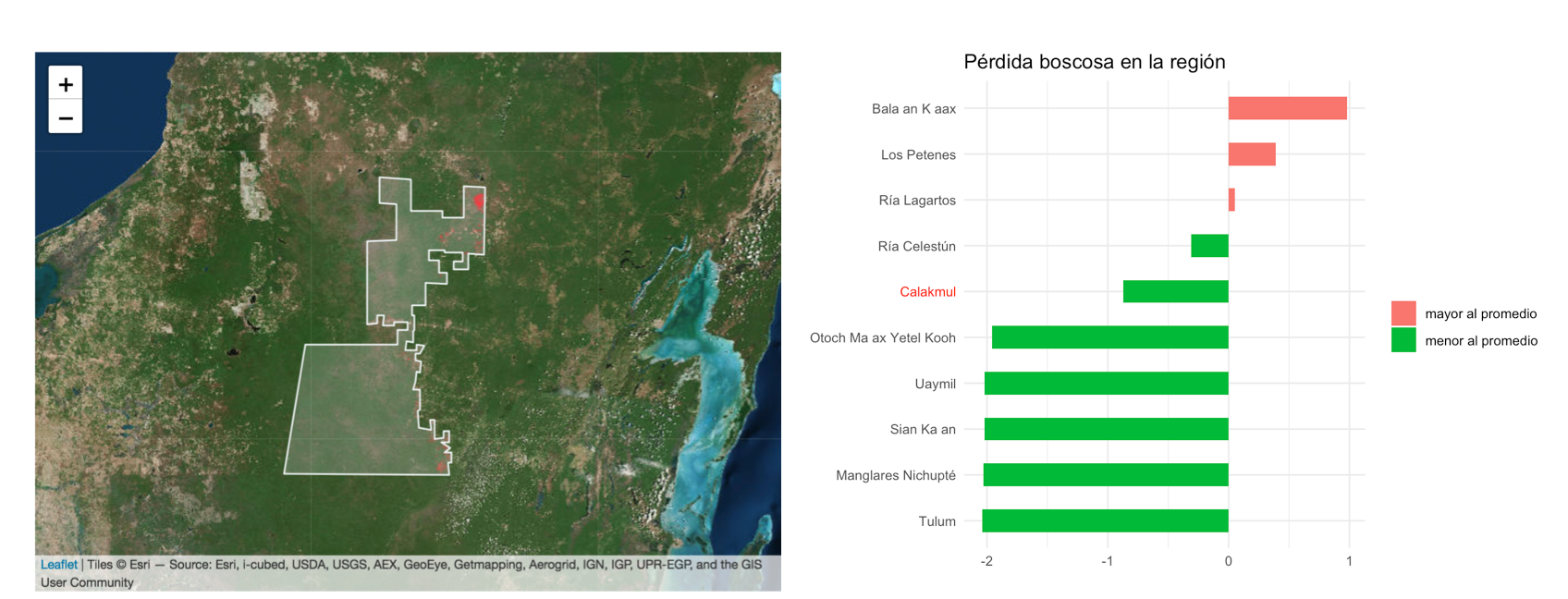
Figura 3. Pérdida de vegetación boscosa en la reserva Calakmul en los últimos 5 años 2012 al 2017
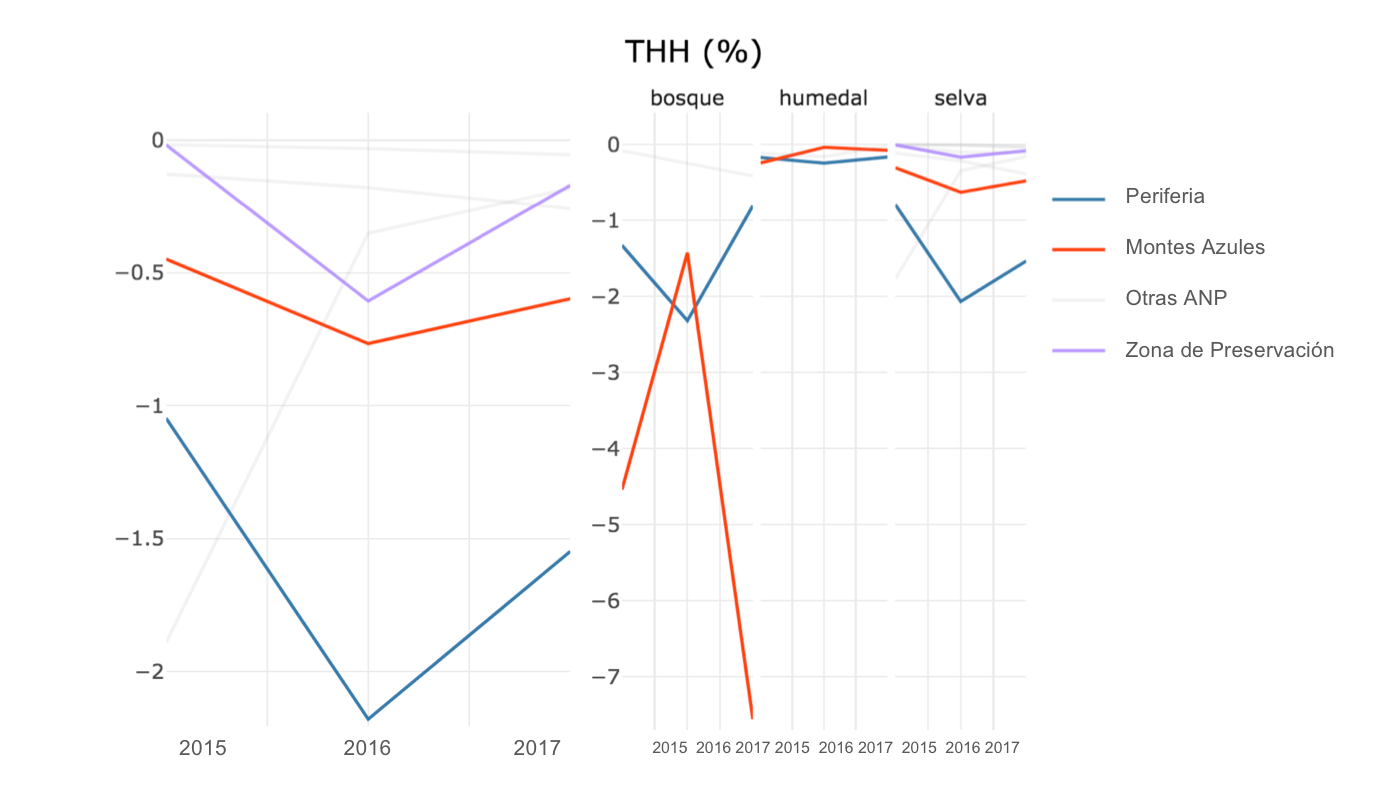
Figura 4. Tasas de transformación del hábitat en los últimos años
Antecedentes MAD-Mex
Las coberturas de 1993, 1995, 1997 y 2000 fueron realizadas con base a imágenes Landsat y Rapid Eye. Se realizaron productos de cambios para los años 2011, 2013 y 2014 y desarrollo en la infraestructura de CONABIO, todo esto en un periodo que abarcó del 2012 al 2015 con el soporte del proyecto ROBIN desarrollado en colaboración con diversas instituciones. Posteriormente del 2016 al 2018 se realizó la integración del sistema con el data cube de Australia, incorporación de segmentadores públicos, debido a que antes se usó uno que requería licencia, se realizó la ampliación de la documentación e instalación e implementación en la nube de amazon. Se realizaron las coberturas de Landsat 2015, Sentinel 2017 y 2018. Así mismo se realizó una serie de tiempo Landsat con un mejor conjunto de entrenamiento más fino que el hecho en el periodo de 2012 al 2015, para el periodo de años entre el 1996 al 2017.
Especies clave
Especies clave: Depredadores Tope
Los depredadores tope son especies clave que se encuentran en los niveles más altos de la cadena trófica. Al ser carnívoros estrictos de talla grande, son importantes reguladores de la estructura del ecosistema y ayudan a preservar la biodiversidad de las comunidades terrestres (Soulé and Terborgh, 1980). Son llamados ingenieros ecosistémicos por el papel que juegan en proveer de recursos a diversas especies como coleópteros, aves y pequeños mamíferosa a partir de los restos que dejan de sus presas como es el caso del puma (Elbroch, et al 2017; Barry et al 2018).
A nivel mundial los depredadores tope están restringidos a pequeñas áreas con respecto a su distribución histórica por lo que la integridad ecosistémica de grandes porciones del planeta estan siendo amenazadas por la alteración de los regímenes de depredación (Estes et al., 2011, Erlinge et al., 1984, Ripple et al., 2014).
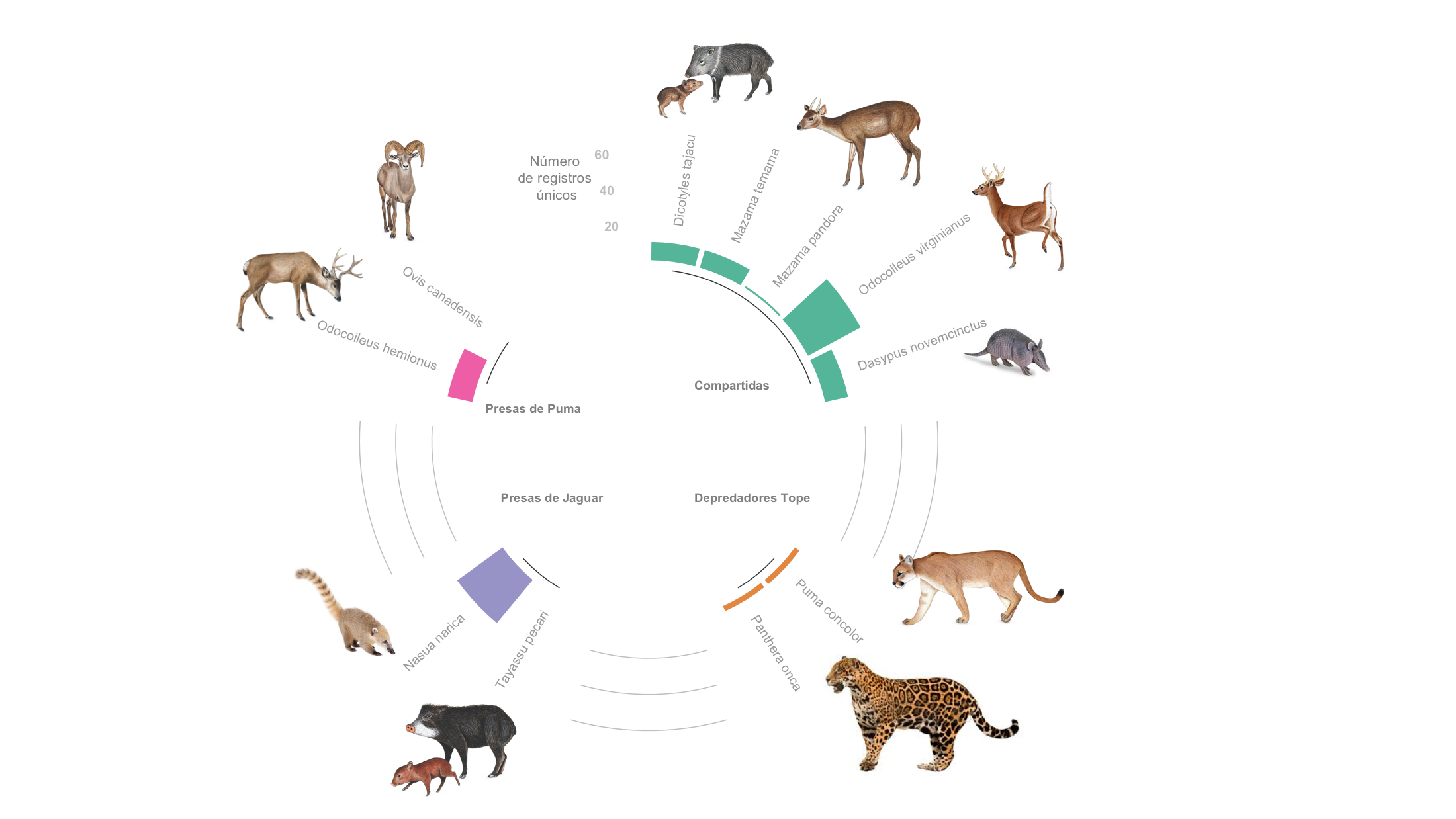
Figura 1. Representatividad del 81.8% de presas y depredadores registradas dentro de Áreas Naturales Protegidas monitoreadas en México con el SNMB, fuera de ellas existe 45.5% de representatividad bajo un esquema de monitoreo similar (SAR-MOD, SNMB).
Aunque los depredadores tope presentan bajas densidades poblacionales (Soulé and Terborgh, 1980), el efecto de la ausencia de ellos sobre todos los niveles tróficos es negativo (Ripple et al 2014). En particular, se sugiere que la pérdida de los altos niveles tróficos tienen un mayor impacto que la pérdida de los productores primarios en el funcionamiento de los ecositemas (Reiss et al., 2009, Cardinale et al., 2006). Por lo que es muy probable que la pérdida local de las especies particularmente de la fauna (i.e.defaunación) tenga graves consecuencias en la prevalencia a largo plazo de los ecosistemas (Dirzo et al., 2014, Hooper et al., 2012).
Los mamíferos depredadores tope en México son el Puma y el Jaguar. Estos son los felinos más grandes y ambos cubren casi todo el territorio nacional. A pesar de presentar una amplia distribución, tienen baja abundancia debido a sus hábitos territoriales, por lo que se requiere de un alto esfuezo de muestreo para su monitoreo. Sin embargo, la presencia de los depredadores es dependiente de la presencia de sus presas. Aquí se evaluó la representatividad de la composición de los depredadores tope y sus principales presas en México como aproximación del estado del esta interacción (depredador-presa).
Método
Se compilaron inventarios de especies de mamíferos (ej.literatura y bases de datos) que son reconocidos como presas principales en las Áreas Naturales Protegidas para contrastar la composición esperada con la registrada en el SNMB a partir de cámaras trampa, huellas y excretas (Figura 1). Es altamente recomendable replicar este ejercicio de evaluación mediante inventarios de referencia en otros sitios como Ecosistemas, Tipos de Vegetación, Estados, Unidades de Manejo, Áreas Protegidas Estatales para tener conocimiento del estado general del país y en diversas regiones destinadas a la conservación.
Calidad de hábitat de especies clave: Depredadores Tope en México
Los depredadores tope son especialmente vulnerables a la degradación y pérdida del hábitat (Lawton, 1995) y fragmentación debido a sus requerimientos en área de su hábitat (Didham et al., 1998, Petchey et al., 1999). Además de la cacería, envenenamiento y muerte por atropellamiento como impactos antropogénicos que amenazan gravemente a estos grupos (Ripple et al 2014). La pérdida o modificación del hábitat de una especie es una de las primeras causas de su extinción (Young et al 2016) y se ha utilizado como una aproximación para estimar la pérdida poblacional (GEO BON, 2015). Debido al costo y tiempo de los estudios poblacionales que requeriría conocer las tendencias para los depredadores tope, se utilizó como proxy a la calidad de su hábitat.
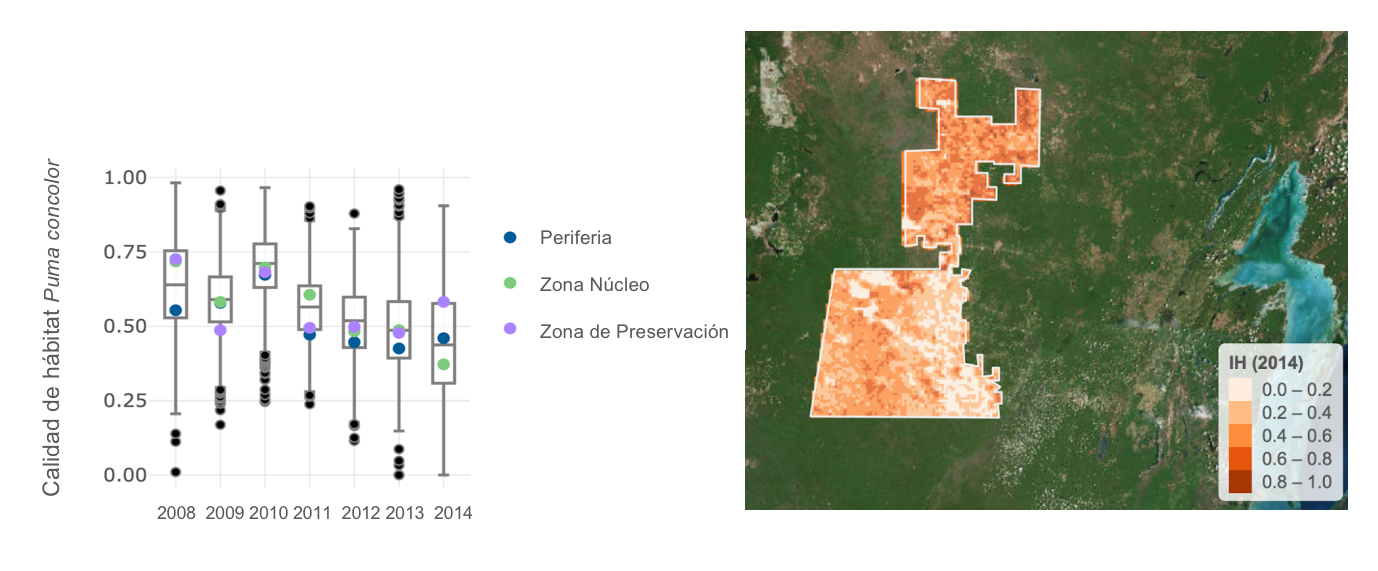
Figura 2. Calidad de hábitat del Puma conocolor en la Reserva de la Biosfera Calakmul en relación a la periferia y zonas núcleo o de preservación.
Las principales causas de transformación del hábitat son antropogénicas. Previo a la transformación total y desaparición del hábitat de una especie particular le antecede un decremento en la calidad de hábitat.
Tabla 1. Valores cercanos a la mayor calidad de hábitat para las variables asociadas a vegetación relevantes en los depredadores tope de México.
| Especie | Variable | Medida | Valor idóneo |
|---|---|---|---|
| Puma concolor | Densidad de árboles | Número de árboles por ha | 408.2 |
| Puma concolor | Cobertura con vegetación no arbórea | Porcentaje de vegetación no arbórea | 30.9 |
| Puma concolor | Cobertura sin vegetación | Porcentaje de vegetación no arbórea | 7.2 |
| Panthera onca | Densidad de árboles | Número de árboles por ha | 778.6 |
| Panthera onca | Heterogeneidad arbórea | Desviación estándar de la altura total del arbolado | 3.04 |
| Panthera onca | Variabilidad de la productiviadad Primaria | Desviación estándar de la producción primaria bruta en temporada de secas | 144.6 |
El método de modelación utilizado está basado en el supuesto teórico y experimental de la existencia de una correlación entre la abundancia y la distancia al centroide de el nicho ecológico (Yañez-Arenas et al. 2012, Martínez-Meyer et al. 2013) en particular de un volúmen similar a un elipsoide (Soberón y Nakamura 2014).
Se calculó la calidad de hábitat para el Puma y el Jaguar a partir de 22 variables ambientales provenientes de imágenes satelitales y de información de la estructura de la vegetación del INFyS (CONAFOR) y localidades de registros recientes de ambos depredadores en el país. Estas variables permitieron caracterizar ambientalmente los sitios donde recientemente se han encontrado con el fin de caracterizar los valores “óptimos” ambientales para los depredadores. De tal forma que las condiciones más cercanas al “centroide de este volumen ambiental” permita reconocer los sitios donde la especie tenga las mejores condiciones para su sobrevivencia.
Así es opsible obtener mapas con valores por sitio (pixeles) que, mientras más parecidos sean al de las valores en el centroide de la especie tiene un mayor valor. Se tienen series anuales de las variables ambientales que permitirán caracterizar la condición del hábitat de cada depredador en el tiempo.
El resultado final es producto de una serie iterativa de generación de modelos, evaluando todas las posibles combinaciones de variables ambientales de tres en tres, y que representa al modelo con mejor desempeño. La medida utilizada de la distancia al centroide del elipsoide del nicho ecológico es la distancia de Mahalanobis (Mahalanobis, 1936).
La razón de usar a los elipsoides como aproximación al nicho ecológico se sustenta en los trabajos teóricos y experimentales que proponen que la forma de los nichos es convexa y que se asemeja a un elipsoide (Birch 1953, Maguire 1967,
Hooper et al. 2008, Angilletta 2009, Soberón and Nakamura 2009, Soberón & Peterson, 2011, Qiao et al., 2016).
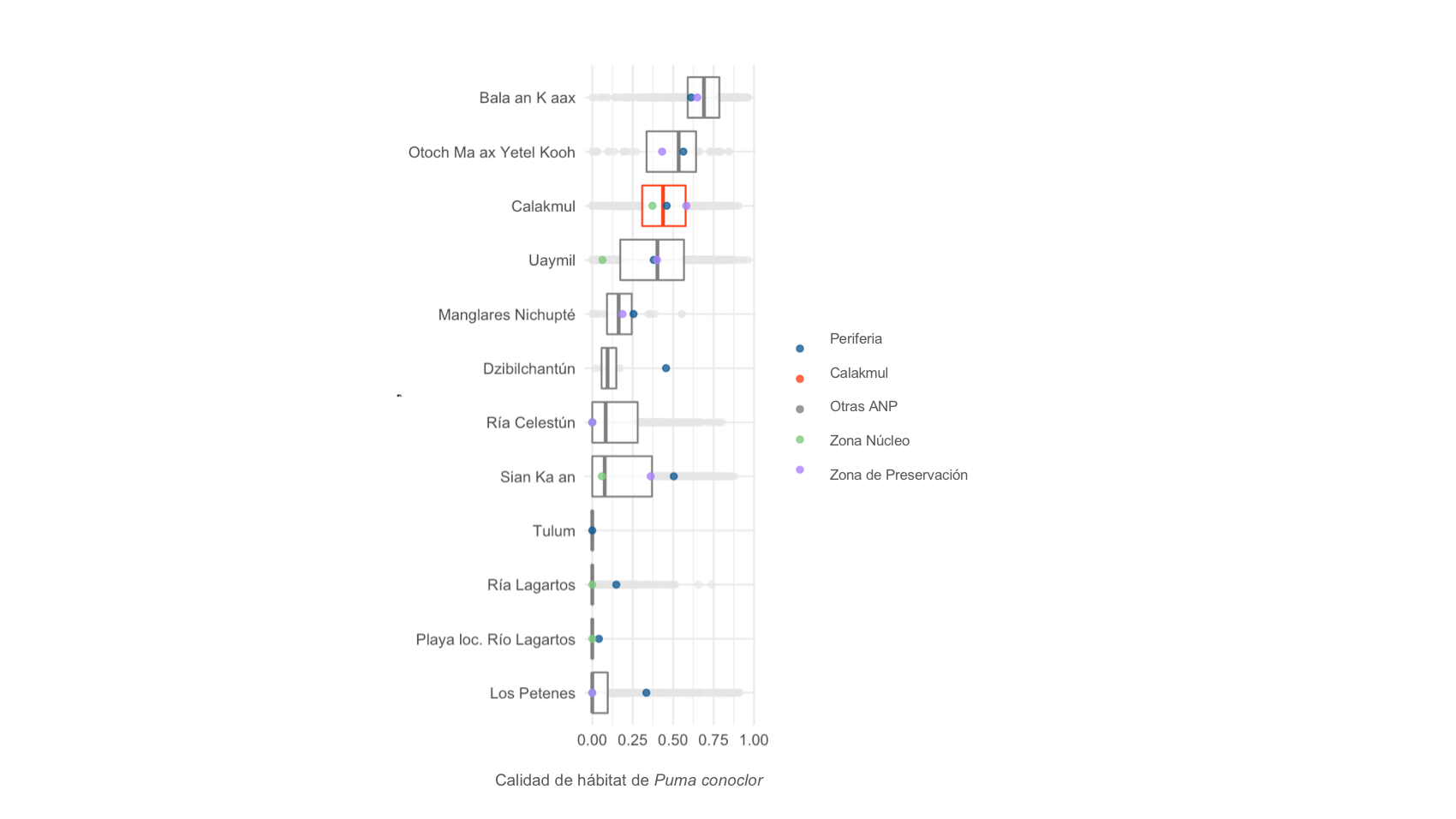
Figura 3. Idoneidad de hábitat en diferentes Áreas Naturales protegidas y su relación con la periferia y zonas núcleo o de preservación.
Diversidad funcional Murciélagos

Ilustración tomada de Kalko et al 2008
Diversidad funcional Murciélagos a partir de grabaciones de sonido ultrasónico
Se identifican las especies de murciélagos con base a las firmas espectrales registradas en campo mediante grabadoras y generando una predicción con modelos estadísticos de clasificación previamente ajustados a los registros espectrales provenientes de la biblioteca de sonidos ultrasónicos (Fonoteca Nacional de Murciélagos). A partir de esta información se calcula la riqueza promedio por hora, diaria, mensual y anual. Además de estimar los “pasos” (proxy de abundancia utilizado en murciélagos registrados por grabadoras) por cada especie.
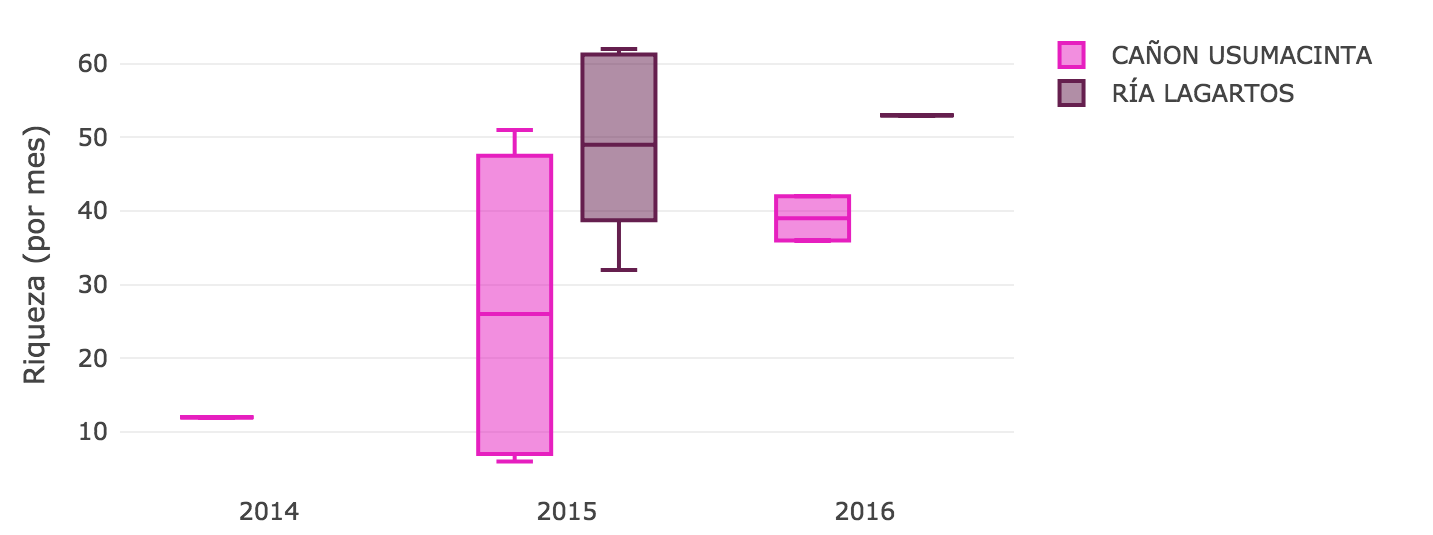
Figura 1. Riqueza de especies en dos Áreas Naturales Protegidas del Sur de México que son parte del SNMB, con un esfuerzo de muestreo similar.
Con base en los caracteres que las especies presentan (como estrategia de forrajeo, estructura del hábitat dónde se alimentan y dieta) se calcula la riqueza y diversidad funcional. Se ha sugerido que la diversidad funcional es un mejor indicador del estado de los ecosistemas que la diversidad taxonómica. Se muestra una comparación entre 2 Áreas Protegidas del neotrópico, el APFyF Cañón del Sumidero (CU) en Tabasco y la RB Ría Lagartos (RL) en Yucatán, con área similar (CU=46128.5ha, RL=60347.8ha), número de conglomerados similar (CU=7, RL=6) muestreadas en RL durante el 2015 y 2016 y en CU durante 2015, 2016, 2017, pero un grado de Integridad Ecosistémica (IE) diferente.** Ría Lagartos presenta un valor de IE de 0.71 y Cañon de Usumacinta de 0.61**.
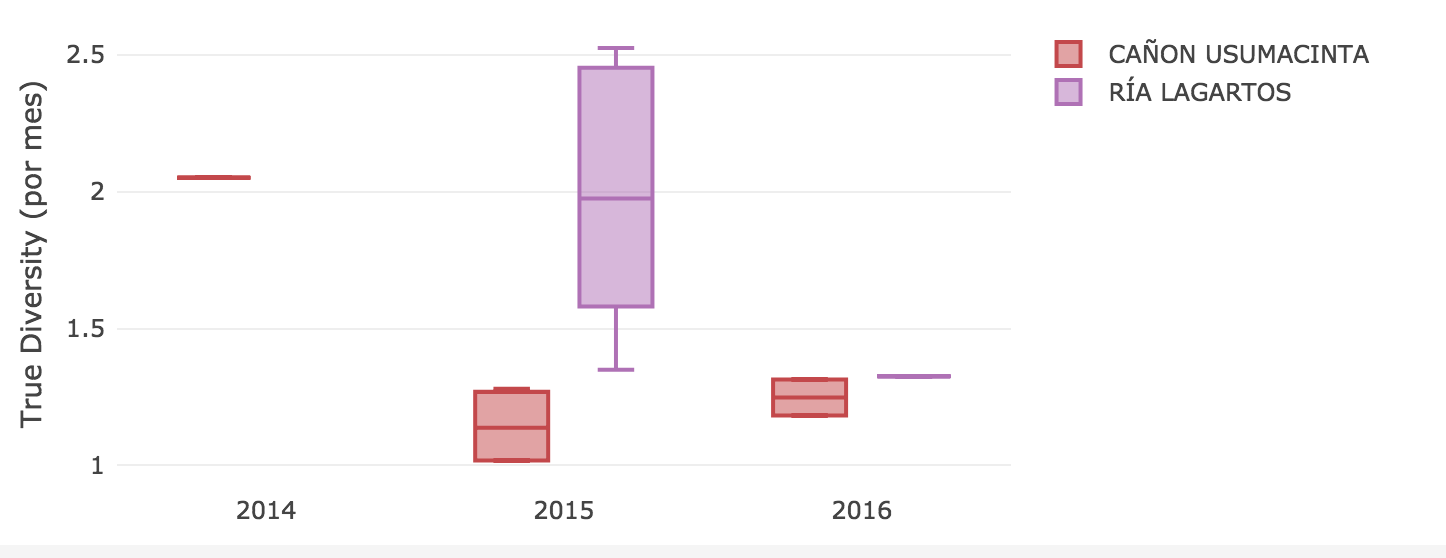
Figura 2. El Índice de diversidad de Hill funcional (1973) -aquí True diversity -es diferente en dos reservas para los murciélagos registrados en AP con una IE diferente auqnue bajo condiciones similares de esfuerzo de muestreo (conglomerados, años, área).
Representatividad funcional de Aves
Representatividad funcional de Aves
Se contrasta el monto de especies obtenida de inventarios y registros en publicaciones y bases de datos existentes (GEF, 2010; Sistema Nacional de Información de la Biodiversidad, 2018; Publicaciones de inventarios de murciélagos y bases de datos de la CONANP) sobre las aves que han sido observadas en cada ANP que ha implemmentado el SNMB del 2015 al 2017. Se identificaron los grupos funcionales al que pertenece cada especie, para estimar la representatividad de funcional registrada mediante los conteos por punto realizados y el registro de avifauna en el fototrampeo (Figura 1). La proporción del número de grupos observado con respecto al esperado en los inventarios confirma el monto de funciones que aún prevalecen. Los grupos no observados no significan ausencia confirmada pero dado el esfuerzo de 3 años de muestreo del SNMB con un máximo de 6 salidas de conteos por punto de aves en los sitios SAR-MOD. En promedio se ha obtenido una representatividad en las ANP evaluadas hasta el momento de 39.9% de los grupos funconales de las aves.
Figura 1. Representatividad de grupos funcionales de las aves mediante observación de aves en el SAR-MOD, SNMB, 2015-2017
La redundancia funcional de especies (i.e. número de especies por grupo funcional) es considerada relevante al reducir la vulnerabilidad ante cascadas de extinción (Sanders et al 2018). La pérdida local de especies por impacto humano puede cambiar la estructura de las comunidades, reduciendo la complejidad de ellas y el grado de interconectividad entre las especies. La frecuencia de número de especies por grupo funcional de las aves que han sido contadas en el SAR-MOD vía el SNMB muestra la frecuencia de especies observada con respecto a la composición de la comunidad histórica de la Área Protegida.
Figura 2. Redundancia de especies y representatividad de grupos funcionales registrada en el SNMB en Ría Lagartos y en el Cañón del Usumacinta mediante Observación directa de aves y fotocolectas Ver http://monitoreo.conabio.gob.mx/i-efectividad/reportes_html/anp_terrestres_2017_NOMBRE_Ria_Lagartos.html) y http://monitoreo.conabio.gob.mx/i-efectividad/reportes_html/anp_terrestres_2017_NOMBRE_Canon_del_Usumacinta.html)
Cabe destacar la vulnerabilidad que se ha reconocido en algunos grupos funcionales como los frugívoros, los que se alimentan en el suelo, aves de presa y herbívoros (Duckworth, G. D. & R. Altwegg, 2018).
Como referencia existen reconocidas 24 grupos funcionales de aves en México, de los cuales en el SNMB se han registrado 19 (79.2%) grupos. En particular el promedio de grupos funcionales por ANP a partir de inventarios históricos es de 16.8, los observados directamente en las Áreas protegidas actualmente en el SNMB en promedio son de 8.8 grupos y 3.9 grupos mediante el fototrampeo.
Los Herbívoros acuáticos se han detectado exclusivamente en las cámaras trampa y los Insectívoro cazadores arbóreos sobre dosel se han detectado exclusivamente mediante observación directa. Los grupos que permanecen aún ausentes son 5 y fueron los Carnívoros arbóreos, los Carnívoros cazadores terrestres, los Granívoros con forrajeo en el suelo y arbóreo, los Insectívoros que forrajean en suelo y follaje, y los Omnívoro acuáticos.
Fauna exótica/invasora
Incidencia de fauna exótica/invasora
Las formas de degradación del hábitat por actividades humanas son múltiples, una de sus facetas menos estudiadas es la del efecto que tiene la fauna doméstica sobre la fauna local en las zonas de contacto o transición entre vegetación perturbada o transformada y la conservada. El SNMB ha registrado que las especies de mastofauna exótica en México más común son el del ganado bovino (Bos taurus), seguido de los perros (Canis lupus familiaris) y de la incidecia de caballos (Equus ansinus). La única especie de fauna invasora de mamíferos que ha sido Felis silvestris.
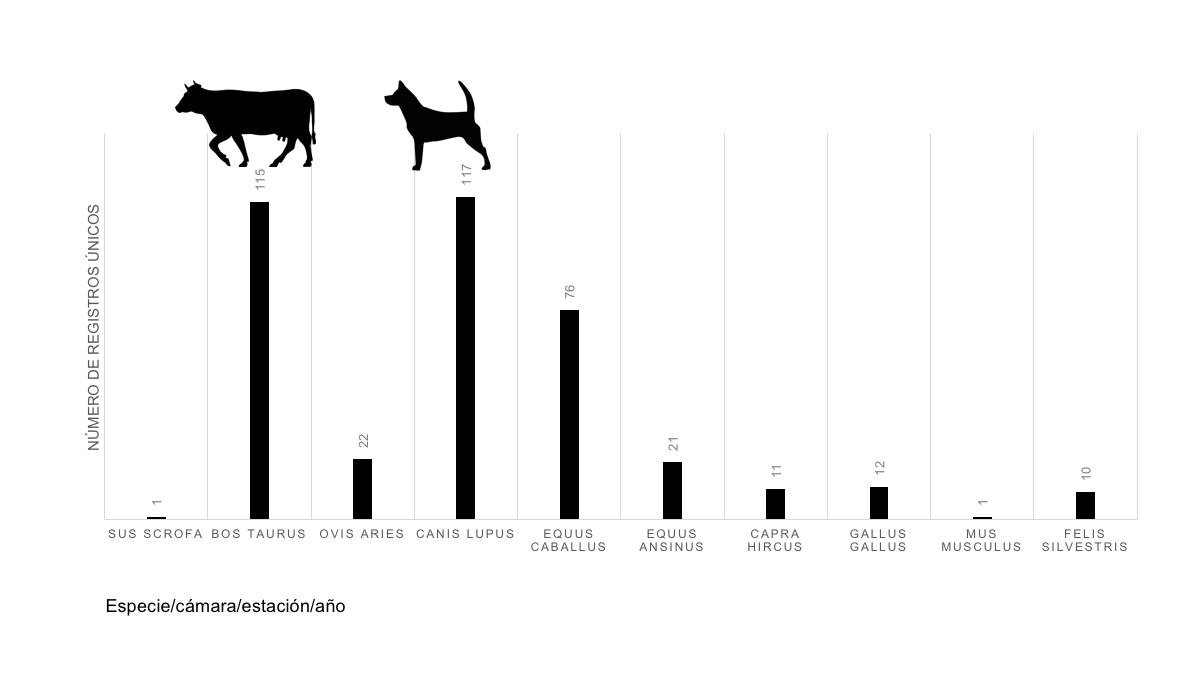
Figura 1. Incidencia de registros en cámaras trampa en el Sistema Nacional de Monitoreo de la Biodiversidad en México (Periodo 2014-2017).
Incidencia de diferentes categorías de tamaño corporal de mamíferos nativos y exóticos en el gradiente de Integridad Ecosistemica en México
Figura 2. Registros únicos detectados mediante cámaras trampa (2014 al 2017), la distribución de frecuencia con base a funciones de densidad mediante el método Kernel fue estimado a lo largo de un gradente de Integridad Ecosistémica. Las especies de diferente tamaño corporal exóticas (E) y nativas (N).
Los mamíferos de talla categorizada como muy grande hace referencia a las especies exóticas (N=217) que pesan entre 80 y 910 kg, mientras que las nativas de la misma categoría (N=225) pesan entre 18.35 y 225 kg. En contraste la talla más pequeña (N=18) tienen un peso entre 32 g y 160g y todas las registradas de este tamaño son nativas. Entre 2 y 14 kg es el rango de especies nativas de talla grande (N=537) y la exóticas de esta talla pesaron todas 6.5kg (N=12). Los pesos corporales fueron obtenidos de la literatura el cual representa el peso promedio entre machos y hembras de la especie.
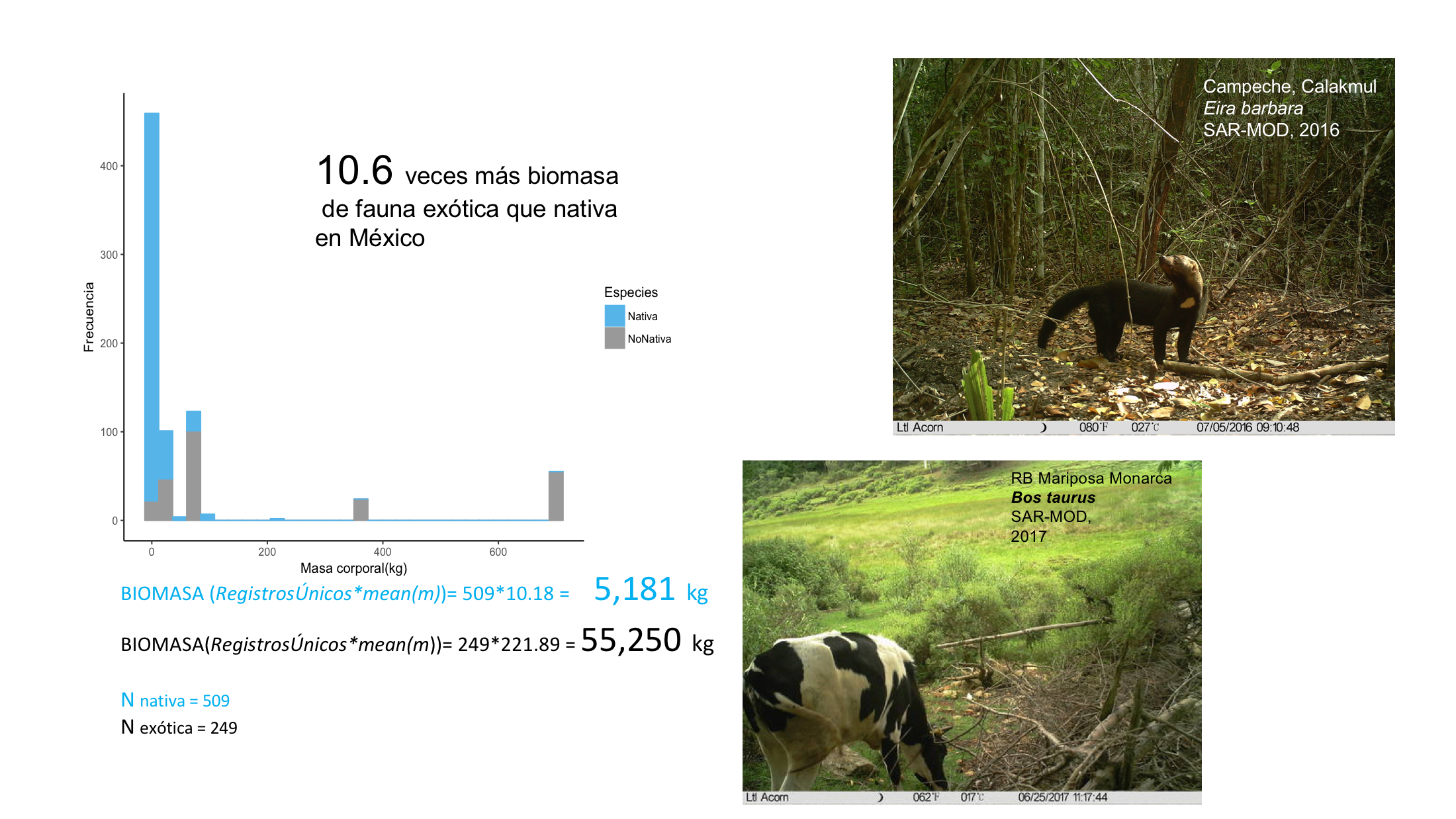
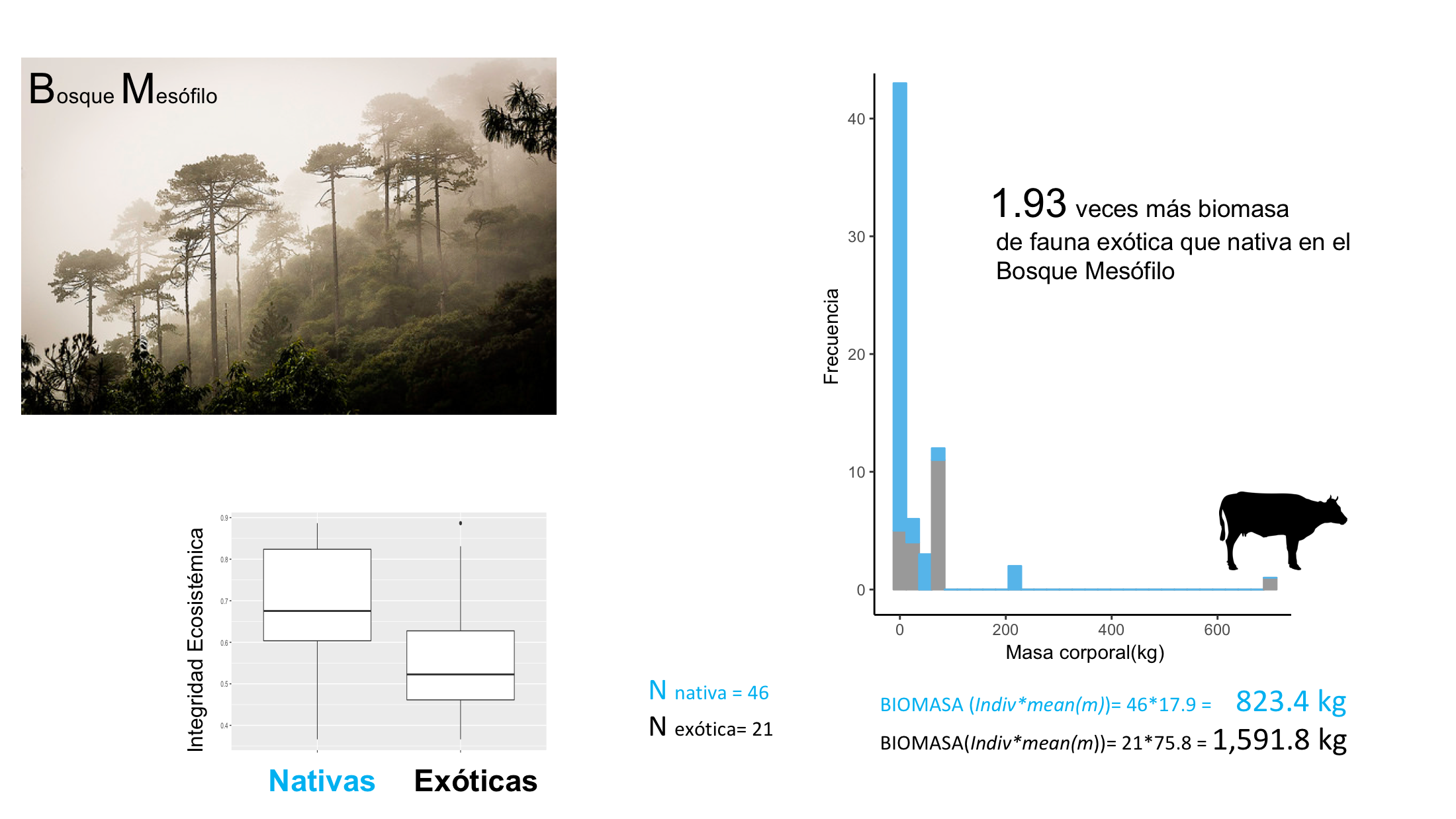
Figura 3. Biomasa comparada registrada en las cámaras trampa del Sistema Nacional de Monitoreo entre especies de mamíferos silvestres y fauna principalmente doméstica. Los registros únicos (ru) se refieren al conteo por Especie/Estación (conglomerado)/Temporada (secas/lluvias)/año. Estos fueron multiplicados por la masa corporal (Frisch-Jordán, 1995) promedio de ambos grupos para tener una aproximaci´ón relativa de la diferencia en biomasa, en este caso para todos los registros de fototrampeo en México (2014 al 2017).
Estado de la Flora invasora
Probabilidad de especies invasoras
Una de las mayores amenazas para la biodiversidad es la introducción de especies exóticas que desplazan a las especies nativas y causan daños a los ecosistemas (McGeoch y Squires, 2015).
Las comunidades ecológicas más persistente, es decir poco perturbadas, con alta integridad, son altamente resistentes a invasiones. Dado que el modelo de IE no incorpora este rubro se explora la tendencia de las especies de flora invasora con los registros en sitios del SNMB.
En particular, se modelarán las principales plantas invasoras registradas en el SNMB con variables de estructura de la vegetación e imágenes satelitales para el monitoreo de la condición anual.
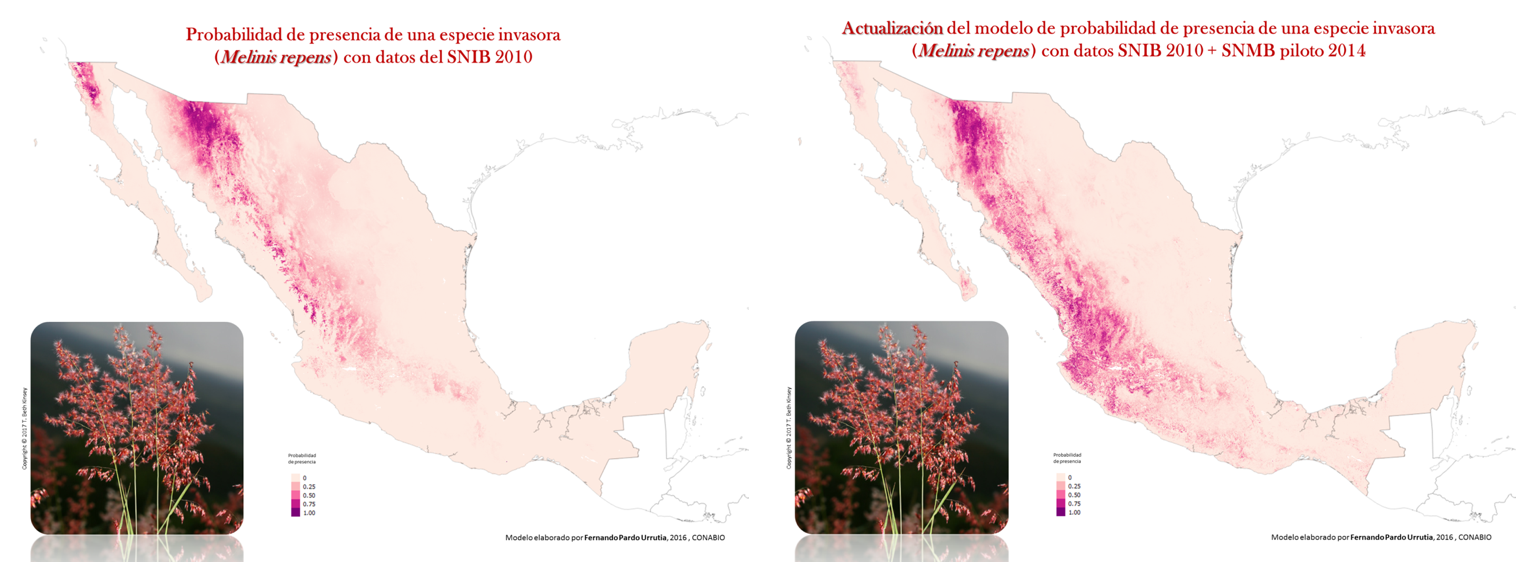
Figura 1. Mapas de idoneidad de hábitat de una especie introducida de África: Melinis reprens. En México se encuentra en todos los estados, y en Chihuahua es una especie dominante en extensas áreas de pastizales. Es una especie naturalizada, exótica e invasora, se predice que puede invadir matorrales xerófilos, mezquitales y bosque tropical deciduo (Melgoza-Castillo et al 2013).
Instituciones y Literatura
Instituciones involucradas en el plan de desarrollo de indicadores de biodiversidad
El Sistema de información ha sido desarrollado, a través del proyecto Resiliencia, el cual es ejecutado por la CONANP e implementado por el PNUD a partir del cofinanciamiento del GEF. En el desarrollo del sistema se reconocen avances que se han alcanzado la participación técnica y financiera de otras dependencias y organizaciones, así como el liderazgo de la CONABIO en su consecución.
Agradecimientos
La CONABIO agradece la colaboración del Instituto de Ecología A.C., Instituto de Geografía, Facultad de Ciencias e Instituto de Biología de la Universidad Nacional Autónoma de México, y de Stanford University, California, USA. Así como a cada uno de los expertos participantes en los talleres convocados por la DGPI, CONABIO en el año 2017 y 2018.
Literatura
Angilletta, M. J. (2009) Thermal adaptation: a theoretical and empirical synthesis. Oxford Univ. Press.
Birch, L. C. (1953) Experimental background to the study of the distribution and abundance of insects: III. The relation between innate capacity for increase and survival of different species of beetles living together on the same food. Evolution 7, pp. 136–144.
Badii, M.H., A. Guillen, C.E. Rodríguez, O. Lugo, J. Aguilar & M. Acuña. 2015. 156 Pérdida de Biodiversidad: Causas y Efectos Biodiversity Loss: Causes and Factors. International Journal of Good Conscience. 10(2)156-174.
Barnosky, A. D., et al. 2011. Has the Earth’s sixth mass extinction already arrived? Nature 471:51–57
Barry, J. M., Elbroch, L. M., Aiello-Lammens, M. E., Sarno, R. J., Seelye, L., Kusler, A., … & Grigione, M. M. 2018. Pumas as ecosystem engineers: ungulate carcasses support beetle assemblages in the Greater Yellowstone Ecosystem. Oecologia, 1-10.
Cardillo, M., G. M. Mace, J. L. Gittleman, K. E. Jones, J. Bielby, and A. Purvis. 2008. The predictability of extinction: biological and external correlates of decline in mammals. Proceedings of the Royal Society B 275:1441–1448.
Challenger A. 1998. Utilización y conservación de los ecosistemas terrestres de México, pasado presente y futuro. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, Instituto de Biología, UNAM, Agrupación Sierra Madre S.C., México.
Clavel, J., R. Julliard & V. Devictor. 2010. Worldwide decline of specialist species: toward a global functional homogenization?. Frontiers in ecology and Environment. doi:10.1890/080216
CONABIO. 2016. Sistema de información sobre especies invasoras en México. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. Consultada: 30/06/2017. URL: http://www.biodiversidad.gob.mx/invasoras
Convenio sobre la Diversidad Biológica.https://www.cbd.int/
Crooks, K. R. 2002. Relative Sensitivities of Mammalian Carnivores to Habitat Fragmentation. Conservation Biology, 16(2):488–502.
Davidson, A. D., M. J. Hamilton, A. G. Boyer, J. H. Brown, and G. Ceballos. 2009. Multiple ecological pathways to extinction in mammals. Proceedings of the National Academy of Sciences USA 106:10702–10705.
Dirzo, R., H.S. Young, M.Galetti, G. Ceballos, J.B.I., Nick, B. Collen. 2014. Defaunation in the Anthropocene. Science, 345(6195):401-406.
Duckworth, G. D. & R. Altwegg.2018. Effectiveness of protected areas for bird conservation depends on guild. Diversity and Distributions. 1-9.
Elbroch, L. M., O’Malley, C., Peziol, M., & Quigley, H. B. 2017. Vertebrate diversity benefiting from carrion provided by pumas and other subordinate, apex felids. Biological Conservation, 215, 123-131.
Estes, J.A., J. Terborgh, J. S. Brashares, M. E. Power, J. Berger, W.J. Bond, S. R. Carpenter, T. E. Essington, R. D. Holt, J. B. C. Jackson, R. J. Marquis, L. Oksanen, T. Oksanen, R.T. Paine, E.K. Pikitch, W. J. Ripple, S. A. Sandin, M. Scheffer, T. W. Schoener, Jo. B. Shurin, A. R. E. Sinclair, M. E. Soulé, R. Virtanen, D. A. Wardle. Trophic Downgrading of Planet Earth. Science, 2011; 333 (6040): 301-306. DOI:10.1126/science.1205106
Equihua Zamora, M., Nashieli García Alaniz, Octavio Pérez-Maqueo, Griselda Benítez Badillo, Melanie Kolb, Michael Schmidt, Julián Equihua Benítez, Pedro Maeda, José Luis Álvarez Palacios. 2014. En: Integridad ecológica como indicador de la calidad ambiental (Ecological integrity as indicator of environmental quality ). En: Bioindicadores: guardianes de nuestro futuro ambiental El Colegio de la Frontera Sur, Instituto Nacional de Ecología y Cambio Climático., pp.687 - 710
Equihua Zamora, M., Griselda Benítez, Octavio Pérez Maqueo, Arturo Hernández Huerta, Nashieli García Alaníz, Julián Equihua Benítez, Pedro Maeda, Melanie Kolb, Michael Schmidt. 2015. Integridad ecológica para la gestión de la sustentabilidad ambiental frente al cambio climático. En: Cambio Climático: Adaptación y Mitigación hacia Agendas Siglo XXI, Chapter: 6, Publisher: AGT Editor S.A. de C.V., Editors: Alejandro Yañez-Aranciba, pp.75 – 8
Fernández, N., Maldonado, C. & Gershenson, C. 2013. Information Measures of Complexity, Emergence, Self-organization, Homeostasis, and Autopoiesis. arXiv, 1304.1842v3.
Farris Z.J., Golden C.D., Karpanty S., Murphy A., Stauffer D., Ratelolahy F., et al. 2015. Hunting, Exotic Carnivores, and Habitat Loss: Anthropogenic Effects on a Native Carnivore Community, Madagascar. PLoS ONE, 10(9): e0136456. https://doi.org/10.1371/journal.pone.0136456.
Fahrig, L. 2003. Effects of Habitat Fragmentation on Biodiversity. Annual Review of Ecology, Evolution, and Systematics, 34(1), 487–515.
Flather C.H., Knowles M.S., Kendall I.A. 1998. Threatened and endangered species geography. BioScience 48: 365–376. Global Biodiversity Change Indicators. 2015. Version 1.2. Group on Earth Observations Biodiversity Observation Network Secretariat. Leipzig, 20 pp.
Fritz, S. A., O. R. P. Bininda-Emonds, and A. Purvis. 2009. Geographical variation in predictors of mammalian extinction risk: big is bad, but only in the tropics. Ecology Letters 12:538–549.
Frisch-Jordán, A. Hábitos y Dietas de los mamíferos Mexicanos como medida alternativa de Diversidad. Universidad Nacional Autónomma de México.1995
Galetti M. & R. Dirzo. 2013. Ecological and evolutionary consequences of living in a defaunated world. Biological Conservation. 163: 1-6.
González-Suárez, M., A. Gómez & E. Revilla. 2013.Which intrinsic traits predict vulnerability to extinction depends on the actual threatening processes.Ecosphere.4(6):1-16
González-Suárez, M. and E. Revilla. 2013. Variability inlife-history and ecological traits is a buffer against extinction in mammals. Ecology Letters 16:242–251.
Haddad, N. M., Brudvig, L. A., Clobert, J., Davies, K. F., Gonzalez, A., Holt, R. D., Townshend, J. R. 2015. Habitat fragmentation and its lasting impact on Earth´s ecosystems, American Association for the Advancement of Science (1(2), 1–9.
Hansen A.J., DeFries R., Turner W. 2004. Land Use Change and Biodiversity: A Synthesis of Rates and Consequences during the Period of Satellite Imagery. In: Gutman G. and Justice C. (eds.) 2004. Land Change Science: Observing, Monitoring, and Understanding Trajectories of Change on the Earth’s Surface. Springer Verlag, New York, NY, pp. 277-299.
Hill, M. O. 1973. Diversity and evenness: a unifying notation and its consequences. Ecology. 54: 427–432. doi:10.2307/1934352.
Kalko EKV, Estrada Villegas S, Schmidt M, Wegmann M, Meyer CFJ. Flying high–assessing the use of the aerosphere by bats. Integr Comp Biol. 2008;48:60–73.
Knut Conradsen Allan A. Nielsen and James J. Simpson. Multivariate alteration detection (mad) and maf postprocessing in multispectral bitemporal image data: New approaches to change detection studies. Remote Sensing of the Environment, 64(1), 1998.
Lee, T. M. and W. Jetz. 2010. Unravelling the structure of species extinction risk for predictive conservation science. Proceedings of the Royal Society B 278:1329–1338
Lambin E.F., Geist H.J. and Lepers E. 2003. Dynamics of land-use and land-cover change in tropical regions. Assessing land use/cover changes: a nationwide multidate spatial database for Mexico. International Journal of Applied Earth Observation and Geoinformation 5: 249-261.Maguire, B. Jr (1967) A partial analysis of the niche. Am. Nat. 101, 515–526.
Mahalanobis, P.C. On the generalised distance in statistics, Proceedings of the National Institute of Science of India 12 (1936) 49-55.
Martínez-Meyer E, Díaz-Porras D, Peterson AT, Yáñez-Arenas C (2013) Ecological niche struc-ture and rangewide abundance patterns of species. Biology Letters 9: 20120637
McGeoch, M.A. and Squires, Z.E. 2015. An Essential Biodiversity Variable approach to monitoring biological invasions: Guide for Countries. GEO BON Technical Series 2, 13 pp.
McKinney, M.L., Lockwood, J.L., 1999. Biotic homogenization: a few winners replac- ing many losers in the next mass extinction. Trends Ecol. Evol. 14, 450–453.
Narayani Barve and Vijay Barve (2016). ENMGadgets: Tools for Pre and Post Processing in ENM workflow. R package version 0.0.12.
Murray, K. A., D. Rosauer, H. McCallum, and L. F. Skerratt. 2011. Integrating species traits with extrinsic threats: closing the gap between predicting and preventing species declines. Proceedings of the Royal Society B 278:1515–1523
Nielsen, A. A. 2007. The regularized iteratively reweighted mad method for change detection in multi- and hyperspectral data. Transactions on Image Processing, 16(2).
Noss, R. F. (1990). Indicators for monitoring biodiversity: a hierarchical approach. Conservation biology, 4(4), 355-364.
Osorio-Olvera L., Barve V., Barve N., Soberón J. (2016) nichetoolbox: From getting biodiversity data to evaluating species distribution models in a friendly GUI environment. R package versión 0.2.0.0.
Osorio-Olvera L., Falconi M, Soberón J (2016) Sobre la relación entre idoneidad del hábitat y la abundancia poblacional bajo diferentes escenarios de dispersión. Revista Mexicana de Biodiversidad 87: 1080–1088
Petchey & K. Gaston. 2002. Functional diversity (FD), species richness and community composition. Ecology Letters.
Parrish, J. D., Braun, D.P., R.S. Unnasch. 2003. Are we conserving what we say we are? Measuring ecological integrity within protected areas. Bioscience, 53, 9: 851-860.
Pijanowski, B.C., L. J. Villanueva-Rivera, S Dumyahn, A. Farina, B. Krause, B. Napoletano, S. Gage and N. Pieretti. 2011. Soundscape Ecology: The Science of Sound in Landscapes. BioScience 61: 203-216.
Purvis, A., J. L. Gittleman, G. Cowlishaw, and G. M. Mace. 2000. Predicting extinction risk in declining species. Proceedings of the Royal Society B 267:1947–1952
Qiao, H., Peterson, A. T., Campbell, L. P., Soberón, J., Ji, L. and Escobar, L. E. (2016), NicheA: creating virtual species and ecological niches in multivariate environmental scenarios. Ecography, 39, pp.
Rodrigues A., Orestes J. and Gaston K. 2000. Flexibility, efficiency, accountability: adapting reserve selection algorithms to more complex conservation problems. Ecography 23: 565-574. Trophic redundancy reduces vulnerability to extinction cascades Dirk Sanders, Elisa Thébault, Rachel Kehoe, F. J. Frank van VeenProceedings of the National Academy of Sciences Mar 2018, 115 (10) 2419-2424; DOI: 10.1073/pnas.1716825115
Schadt, S., F. Knauer, P. Kaczensky, E. Revilla, T. Wiegand, L. Trepl. 2002. Rule based assessment of suitabe hábitat and patch connectivity for the eurasian lynx.Ecological Applications, 12(5), 2002, pp. 1469–1483
Soberón, J. and Nakamura, M. (2009) Niches and distributional areas: concepts, methods, and assumptions. Proc. Natl Acad. Sci. USA 106, pp. 19644–19650.
Soberón J., Peterson T.A., Osorio-Olvera L. 2018. A comment on “Species are not most abundant in the centre of their geographic range or climatic niche”. Rethinking Ecology 3: 13–18.
Peterson A.T., Papes M., Soberón J. (2008) Rethinking
receiver operating characteristic analysis applications in ecological niche modeling. Ecological modelling 213:63–72.
Soulé, M. E. & J. Terborgh. Continental Conservation, Scientific Foundations of regional reserve networks. 1999. 227 pp
Smart, Simon M., Ken Thompson, Robert H. Marrs, Mike G. Le Duc, Lindsay C. Maskell y Leslie G. Firbank. Proc. R. Soc. 273:2659-2665.
Soberón, J., and Townsend Peterson, A. 2011. Ecological niche shifts and environmental space anisotropy: A cautionary note. Revista Mexicana de Biodiversidad, 82(4), 1348–1355.
Tscharntke, T., Steffan-Dewenter, I., Kruess, A. & Thies, C. 2002. Characteristics of insect populations on habitat fragments: a mini review. Ecological Research, 17, 229–239.
Velázquez A., Mas J.F., Díaz-Gallegos J.R., Mayorga-Saucedo R., Alcántara P.C., Castro R., Fernández T., Bocco G., Ezcurra E. y Palacio J.L. 2002. Patrones y tasas de cambio de uso del suelo en México. Gaceta 62: 21-37.
Vitousek P. M., Mooney H. A.; Lubchenco J. and Melillo J. M. 1997. Human domination of Earth´s ecosystems. Science 277: 494-499.
Young, H. S., D. J. McCauley, M. Galetti, & R. Dirzo. 2016 Patterns, Causes, and Consequences of Anthropocene Defaunation. The Annual Review of Ecology, Evolution, and Systematics. 47:333–58.
Yañez-Arenas C, Martínez-Meyer E, Mandujano S, Rojas-Soto O (2012) Modelling geographic patterns of population density of the white-tailed deer in central Mexico by implement-ing ecological niche theory. Oikos 121: 2081–2089.
Weckel, M., W. Giuliano y S. Silver. 2006. Jaguar feeding ecology: distribution of predator and prey through time and space. Journal of Zoology 270: 25-30
González-Salazar, C., E. Martínez-Meyer & G. López-Santiago. 2014. Revista Mexicana de Biodiversidad. A hierarchical classification of trophic guilds for North American birds and mammals. Clasificación jerárquica de gremios tróficos para aves y mamíferos de Norteamérica.85: 931-941.
Chinchilla, F. 1997. La dieta del jaguar, el puma y el manigordo en el Parque Nacional Corcovado, Costa Rica. Revista de Biología Tropical 45 (3): 1223-1229.
Estrada, C.G. 2008. Dieta, uso de hábitat y patrones de actividad del puma y el jaguar en la Selva Maya, Centroamérica. Revista Mexicana de Mastozoología 12: 113-130.
Núñez, R., B. Miller y F. Lindsey. 2000. Food habita of jaguars and pumas in Jalisco, México.Journal of Zoology London 252: 373-379.
Rueda, P., G.D. Mendoza, D. Martínez y O.C. Rosas-Rosas. 2013. Determination of the jaguar and puma diet in a tropical forest in San Luis Potosi, Mexico. Journal of Applied Animal Research 41 (4): 484-489.